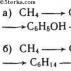Образованные на основе бензола. При нормальных условиях представляют собой твердые ядовитые вещества, обладающие специфическим ароматом. В современной промышленности эти химические соединения играют далеко не последнюю роль. По объемам использования фенол и его производные входят в двадцатку наиболее востребованных химических соединений в мире. Они широко применяются в химической и легкой промышленности, фармацевтике и энергетике. Поэтому получение фенола в промышленных масштабах - одна из основных задач химической промышленности.
Обозначения фенола
Первоначальное название фенола - карболовая кислота. Позднее данное соединение поучило название «фенол». Формула этого вещества представлена на рисунке:
Нумерация атомов фенола ведется от того атома углерода, который соединен с гидроксогруппой ОН. Последовательность продолжается в таком порядке, чтобы другие замещенные атомы получили наименьшие номера. Производные фенола существуют в виде трех элементов, характеристики которых объясняются различием их структурных изомеров. Различные орто-, мета-, паракрезолы являются лишь видоизменением основной структуры соединения бензольного кольца и гидроксильной группы, базовая комбинация которой и представляет собой фенол. Формула этого вещества в химической записи выглядит как C 6 H 5 OH.
Физические свойства фенола
Визуально фенол представляет собой твердые бесцветные кристаллы. На открытом воздухе они окисляются, придавая веществу характерный розовый оттенок. При нормальных условиях фенол довольно плохо растворяется в воде, но с повышением температуры до 70 о этот показатель резко возрастает. В щелочных растворах это вещество растворимо в любых количествах и при любых температурах.

Эти свойства сохраняются и в других соединениях, основным компонентом которых являются фенолы.
Химические свойства
Уникальные свойства фенола объясняются его внутренней структурой. В молекуле этого химического вещества р-орбиталь кислорода образует единую п-систему с бензольным кольцом. Такое плотное взаимодействие повышает электронную плотность ароматического кольца и понижает этот показатель у атома кислорода. При этом полярность связей гидроксогруппы значительно увеличивается, и водород, входящий в ее состав, легко замещается любым щелочным металлом. Так образуются различные феноляты. Эти соединения не разлагаются водой, как алкоголяты, но их растворы очень похожи на соли сильных оснований и слабых кислот, поэтому они имеют достаточно выраженную щелочную реакцию. Феноляты взаимодействуют с различными кислотами, в результате реакции восстанавливаются фенолы. Химические свойства этого соединения позволяют ему взаимодействовать с кислотами, образуя при этом сложные эфиры. Например, взаимодействие фенола и уксусной кислоты приводит к образованию финилового эфира (фениацетата).

Широко известна реакция нитрирования, в которой под воздействием 20% азотной кислоты фенол образует смесь пара- и ортонитрофенолов. Если воздействовать на фенол концентрированной азотной кислотой, то получается 2,4,6-тринитрофенол, который иногда называют пикриновой кислотой.

Фенол в природе
Как самостоятельное вещество фенол в природе содержится в каменноугольной смоле и в отдельных сортах нефти. Но для промышленных нужд это количество не играет никакой роли. Поэтому получение фенола искусственным способом стало приоритетной задачей для многих поколений ученых. К счастью, эту проблему удалось разрешить и получить в итоге искусственный фенол.
Свойства, получение
Применение различных галогенов позволяет получать феноляты, из которых при дальнейшей обработке образуется бензол. Например, нагревание гидроксида натрия и хлорбензола позволяет получить натрия фенолят, который при воздействии кислоты распадается на соль, воду и фенол. Формула такой реакции приведена здесь:
С 6 Н 5 -CI + 2NaOH -> С 6 Н 5 -ONa + NaCl + Н 2 O
Ароматические сульфокислоты также являются источником для получения бензола. Химическая реакция проводится при одновременном плавлении щелочи и сульфокислоты. Как видно из реакции, сначала образуются феноксиды. При обработке сильными кислотами они восстанавливаются до многоатомных фенолов.
Фенол в промышленности
В теории, получение фенола самым простым и многообещающим способом выглядит таким образом: при помощи катализатора бензол окисляют кислородом. Но до сих пор катализатор для этой реакции так и не был подобран. Поэтому в настоящее время в промышленности используются другие методы.
Непрерывный промышленный способ получения фенола состоит во взаимодействии хлорбензола и 7% раствора едкого натра. Полученную смесь пропускают через полуторакилометровую систему труб, нагретых до температуры в 300 С. Под воздействием температуры и поддерживаемого высокого давления исходные вещества вступают в реакцию, в результате которой получат 2,4-динитрофенол и другие продукты.

Не так давно был разработан промышленный способ получения фенолсодержащих веществ кумольным методом. Этот процесс состоит из двух этапов. Сначала из бензола получают изопропилбензол (кумол). Для этого бензол алкируют с помощью пропилена. Реакция выглядит следующим образом:

После этого кумол окисляют кислородом. На выходе второй реакции получают фенол и другой важный продукт — ацетон.
Получение фенола в промышленных масштабах возможно из толуола. Для этого толуол окисляется на кислороде, содержащемся в воздухе. Реакция протекает в присутствии катализатора.
Примеры фенолов
Ближайшие гомологи фенолов называются крезолами.

Существуют три разновидности крезолов. Мета-крезол при нормальных условиях представляет собой жидкость, пара-крезол и орто-крезол - твердые вещества. Все крезолы плохо растворяются в воде, а по своим химическим свойствами они почти аналогичны фенолу. В естественном виде крезолы содержатся в каменноугольной смоле, в промышленности их применяют при производстве красителей, некоторых видов пластмасс.
Примерами двухатомных фенолов могут служить пара-, орто- и мета-гидробензолы. Все они представляют собой твердые вещества, легко растворимые в воде.
Единственный представитель трехатомного фенола - пирогаллол (1,2,3-тригидроксибензол). Его формула представлена ниже.

Пирогаллол является довольно сильным восстановителем. Он легко окисляется, поэтому его используют для получения очищенных от кислорода газов. Это вещество хорошо известно фотографам, его используют как проявитель.
Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле (рис.1)
Рис. 1. ОДНО-, ДВУХ- И ТРЕХАТОМНЫЕ ФЕНОЛЫ
В соответствии с количеством конденсированных ароматических циклов в молекуле различают (рис. 2) сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы (рис. 2).
Рис. 2. МОНО- И ПОЛИЯДЕРНЫЕ ФЕНОЛЫ
Номенклатура спиртов.
Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях замещенных моноядерных фенолов используются также приставки орто- , мета- и пара -, употребляемые в номенклатуре ароматических соединений. Для более сложных соединений нумеруют атомы , входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей (рис. 3).
Рис. 3. НОМЕНКЛАТУРА ФЕНОЛОВ . Замещающие группы и соответствующие цифровые индексы для наглядности выделены различными цветами.
Химические свойства фенолов.
Бензольное ядро и ОН-группа, объединенные в молекуле фенола, влияют друг на друга, существенно повышая реакционную способность друг друга. Фенильная группа оттягивает на себя неподеленную электронную пару от атома кислорода в ОН-группе (рис. 4). В результате на атоме Н этой группы увеличивается частичный положительный заряд (обозначен значком d+), полярность связи О–Н возрастает, что проявляется в увеличении кислотных свойств этой группы. Таким образом, в сравнении со спиртами, фенолы представляют собой более сильные кислоты. Частичный отрицательный заряд (обозначен через d–), переходя на фенильную группу, сосредотачивается в положениях орто- и пара- (по отношению к ОН-группе). Эти реакционные точки могут атаковаться реагентами, тяготеющими к электроотрицательным центрам, так называемыми электрофильными («любящими электроны») реагентами.
Рис. 4. РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В ФЕНОЛЕ
В итоге для фенолов возможны два типа превращений: замещение атома водорода в ОН-группе и замещение Н-атомобензольном ядре. Пара электронов атома О, оттянутая к бензольному кольцу, увеличивает прочность связи С–О, поэтому реакции, протекающие с разрывом этой связи, характерные для спиртов, для фенолов не типичны.
1. Реакции замещения атома водорода в ОН-группе. При действии на фенолы щелочей образуются феноляты (рис. 5А), каталитическое взаимодействие со спиртами приводит к простым эфирам (рис. 5Б), а в результате реакции с ангидридами или хлорангидридами карбоновых кислот образуются сложные эфиры (рис. 5В). При взаимодействии с аммиаком (повышенная температура и давление) происходит замена ОН-группы на NH 2 , образуется анилин, (рис. 5Г), восстанавливающие реагенты превращают фенол в бензол (рис. 5Д)
2. Реакции замещения атомов водорода в бензольном кольце.
При галогенировании, нитровании, сульфировании и алкилировании фенола атакуются центры с повышенной электронной плотностью (рис.4), т.е. замещение проходят преимущественно в орто- и пара- положениях (рис.6).
При более глубоком протекании реакции происходит замещение двух и трех атомов водорода в бензольном кольце.
Особое значение имеют реакции конденсации фенолов с альдегидами и кетонами, по существу, это алкилирование, проходящее легко и в мягких условиях (при 40–50° С, водная среда в присутствии катализаторов), при этом атом углерода в виде метиленовой группы СН 2 или замещенной метиленовой группы (CНR либо CR 2) встраивается между двумя молекулами фенола. Часто такая конденсация приводит к образованию полимерных продуктов (рис. 7).
Двухатомный фенол (торговое название бисфенол А, рис.7), используют в качестве компонента при получении эпоксидных смол. Конденсация фенола с формальдегидом лежит в основе производства широко применяемых феноло-формальдегидных смол (фенопласты).
Способы получения фенолов.
Фенолы выделяют из каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь). Промышленный способ получения самого фенола С 6 Н 5 ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H 2 SO 4 (рис. 8А). Реакция проходит с высоким выходом и привлекательна тем, что позволяет получить сразу два технически ценных продукта – фенол и ацетон. Другой способ – каталитический гидролиз галогензамещенных бензолов (рис. 8Б).
Рис. 8. СПОСОБЫ ПОЛУЧЕНИЯ ФЕНОЛА
Применение фенолов.
Раствор фенола используют в качестве дезинфицирующего средства (карболовая кислота). Двухатомные фенолы – пирокатехин, резорцин (рис. 3), а также гидрохинон (пара- дигидроксибензол) применяют как антисептики (антибактериальные обеззараживающие вещества), вводят в состав дубителей для кожи и меха, как стабилизаторы смазочных масел и резины, а также для обработки фотоматериалов и как реагенты в аналитической химии.
В виде отдельных соединений фенолы используются ограниченно, зато их различные производные применяют широко. Фенолы служат исходными соединениями для получения разнообразных полимерных продуктов – феноло-альдегидных смол (рис. 7), полиамидов, полиэпоксидов. На основе фенолов получают многочисленные лекарственные препараты, например, аспирин, салол, фенолфталеин, кроме того, красители, парфюмерные продукты, пластификаторы для полимеров и средства защиты растений.
Михаил Левицкий
Образованные на основе бензола. При нормальных условиях представляют собой твердые ядовитые вещества, обладающие специфическим ароматом. В современной промышленности эти химические соединения играют далеко не последнюю роль. По объемам использования фенол и его производные входят в двадцатку наиболее востребованных химических соединений в мире. Они широко применяются в химической и легкой промышленности, фармацевтике и энергетике. Поэтому получение фенола в промышленных масштабах - одна из основных задач химической промышленности.
Обозначения фенола
Первоначальное название фенола - карболовая кислота. Позднее данное соединение поучило название «фенол». Формула этого вещества представлена на рисунке:
Нумерация атомов фенола ведется от того атома углерода, который соединен с гидроксогруппой ОН. Последовательность продолжается в таком порядке, чтобы другие замещенные атомы получили наименьшие номера. Производные фенола существуют в виде трех элементов, характеристики которых объясняются различием их структурных изомеров. Различные орто-, мета-, паракрезолы являются лишь видоизменением основной структуры соединения бензольного кольца и гидроксильной группы, базовая комбинация которой и представляет собой фенол. Формула этого вещества в химической записи выглядит как C 6 H 5 OH.
Физические свойства фенола
Визуально фенол представляет собой твердые бесцветные кристаллы. На открытом воздухе они окисляются, придавая веществу характерный розовый оттенок. При нормальных условиях фенол довольно плохо растворяется в воде, но с повышением температуры до 70 о этот показатель резко возрастает. В щелочных растворах это вещество растворимо в любых количествах и при любых температурах.

Эти свойства сохраняются и в других соединениях, основным компонентом которых являются фенолы.
Химические свойства
Уникальные свойства фенола объясняются его внутренней структурой. В молекуле этого химического вещества р-орбиталь кислорода образует единую п-систему с бензольным кольцом. Такое плотное взаимодействие повышает электронную плотность ароматического кольца и понижает этот показатель у атома кислорода. При этом полярность связей гидроксогруппы значительно увеличивается, и водород, входящий в ее состав, легко замещается любым щелочным металлом. Так образуются различные феноляты. Эти соединения не разлагаются водой, как алкоголяты, но их растворы очень похожи на соли сильных оснований и слабых кислот, поэтому они имеют достаточно выраженную щелочную реакцию. Феноляты взаимодействуют с различными кислотами, в результате реакции восстанавливаются фенолы. Химические свойства этого соединения позволяют ему взаимодействовать с кислотами, образуя при этом сложные эфиры. Например, взаимодействие фенола и уксусной кислоты приводит к образованию финилового эфира (фениацетата).

Широко известна реакция нитрирования, в которой под воздействием 20% азотной кислоты фенол образует смесь пара- и ортонитрофенолов. Если воздействовать на фенол концентрированной азотной кислотой, то получается 2,4,6-тринитрофенол, который иногда называют пикриновой кислотой.

Фенол в природе
Как самостоятельное вещество фенол в природе содержится в каменноугольной смоле и в отдельных сортах нефти. Но для промышленных нужд это количество не играет никакой роли. Поэтому получение фенола искусственным способом стало приоритетной задачей для многих поколений ученых. К счастью, эту проблему удалось разрешить и получить в итоге искусственный фенол.
Свойства, получение
Применение различных галогенов позволяет получать феноляты, из которых при дальнейшей обработке образуется бензол. Например, нагревание гидроксида натрия и хлорбензола позволяет получить натрия фенолят, который при воздействии кислоты распадается на соль, воду и фенол. Формула такой реакции приведена здесь:
С 6 Н 5 -CI + 2NaOH -> С 6 Н 5 -ONa + NaCl + Н 2 O
Ароматические сульфокислоты также являются источником для получения бензола. Химическая реакция проводится при одновременном плавлении щелочи и сульфокислоты. Как видно из реакции, сначала образуются феноксиды. При обработке сильными кислотами они восстанавливаются до многоатомных фенолов.
Фенол в промышленности
В теории, получение фенола самым простым и многообещающим способом выглядит таким образом: при помощи катализатора бензол окисляют кислородом. Но до сих пор катализатор для этой реакции так и не был подобран. Поэтому в настоящее время в промышленности используются другие методы.
Непрерывный промышленный способ получения фенола состоит во взаимодействии хлорбензола и 7% раствора едкого натра. Полученную смесь пропускают через полуторакилометровую систему труб, нагретых до температуры в 300 С. Под воздействием температуры и поддерживаемого высокого давления исходные вещества вступают в реакцию, в результате которой получат 2,4-динитрофенол и другие продукты.

Не так давно был разработан промышленный способ получения фенолсодержащих веществ кумольным методом. Этот процесс состоит из двух этапов. Сначала из бензола получают изопропилбензол (кумол). Для этого бензол алкируют с помощью пропилена. Реакция выглядит следующим образом:

После этого кумол окисляют кислородом. На выходе второй реакции получают фенол и другой важный продукт — ацетон.
Получение фенола в промышленных масштабах возможно из толуола. Для этого толуол окисляется на кислороде, содержащемся в воздухе. Реакция протекает в присутствии катализатора.
Примеры фенолов
Ближайшие гомологи фенолов называются крезолами.

Существуют три разновидности крезолов. Мета-крезол при нормальных условиях представляет собой жидкость, пара-крезол и орто-крезол - твердые вещества. Все крезолы плохо растворяются в воде, а по своим химическим свойствами они почти аналогичны фенолу. В естественном виде крезолы содержатся в каменноугольной смоле, в промышленности их применяют при производстве красителей, некоторых видов пластмасс.
Примерами двухатомных фенолов могут служить пара-, орто- и мета-гидробензолы. Все они представляют собой твердые вещества, легко растворимые в воде.
Единственный представитель трехатомного фенола - пирогаллол (1,2,3-тригидроксибензол). Его формула представлена ниже.

Пирогаллол является довольно сильным восстановителем. Он легко окисляется, поэтому его используют для получения очищенных от кислорода газов. Это вещество хорошо известно фотографам, его используют как проявитель.
Производство фенола сульфированием бензола.
Расчеты по производству фенола 1000р
Синтетический фенол в промышленном масштабе был получен впервые в 1899 г. на Баденской анилино - содовой фабрике сульфированием бензола. С тех пор этот метод, в значительной степени, видоизмененной и улучшенный, широко применяется во многих странах мира.
Сульфирование бензола
С6Н6+Н2SО4=С6Н5SО3Н+Н2О
Нейтрализация сульфокислоты
2С6Н5SО3Н+Na2SО3 =2С6Н5SО3 Na+Н2О+SО2
Щелочное плавление
С6Н5 SО3 Na+2 NaОН=С6Н5 О Na+ Na2SО3+Н2О
Разложение фенолята натрия
2 С6Н5 О Na+ SО2+Н2О=2С6Н5 ОН+ Na2SО3
Сульфирование бензола можно проводить в жидкой фазе, в паровой фазе и двухступенчатым методом.
Метод сульфирования бензола в паровой фазе был разработан Р.К. Эйхманом и является наиболее экономичным. Себестоимость фенола, полученного по этому методу, на 10% ниже себестоимости фенола, производимого по применяемому в ФРГ методу сульфирования бензола в жидкой фазе, и на 6% ниже себестоимости фенола, вырабатываемого по методу, распространенному в США (двухступенчатый метод).
Парофазный процесс сульфирования бензола проводиться непрерывным способом. Пары бензола поступают параллельно через барботеры в четыре каскадно-расположенных сульфуратора, снабженных мешалками и рубашками. На сульфирование подается 94-95%-ная серная кислота, которая вводится через барботеры в первый из сульфураторов. Образующаяся сульфомасса последовательно перетекает из донного сульфуратора в другой. При сульфировании протекают следующие побочные реакции:
а) образование дифенилсульфона:
С6Н5SО3Н+С6Н6?С6Н5SО2С6Н5+Н2О
б) Образование дисульфокислоты бензола:
С6Н5SО3Н+Н2SО4?С6Н4(SО3Н)2+ Н2О
в) полное окисление бензола:
С6Н6+15 SО3?6СО2+3 Н2О+15 SО2
Эти нежелательные реакции ускоряются при повышении температуры, вследствие чего в сульфураторах поддерживается температура не выше 160?С. Пары воды и бензола, выделяющиеся при сульфировании, конденсируются, а отслоившийся бензол после нейтрализации возвращается на сульфирование.
Полученная сульфомасса поступает на отдувку бензола, поскольку при температуре сульфирования растворяется около 1,5% бензола от веса сульфомассы. В результате отдувки, проводимой в вакууме или с помощью инертного газа, содержание бензола в ней снижается до 0,1-0,2%.
Пары бензола, выделившиеся при отдувке, частично конденсируются, остаток бензола адсорбируется из газов. Бензол, полученный при конденсации и регенерации адсорбента, присоединяется к возвратному бензолу.
Сульфомасса после отгонки бензола подвергается непрерывной нейтрализации суспензий сульфита натрия. Образующийся при этом сернистый газ используется в дальнейшем для разложения фенолята натрия.
Насыщенный раствор сульфосоли поступает на щелочное плавление, которое проводиться периодически в котле, обогреваемом топочными газами. Для плавления применяют 80-85%-ный раствор NaОН; процесс ведут при 285-315?С.
На этой стадии протекают побочные реакции, в результате которых образуются о- ип-оксидифенилы С6Н5С6Н4ОН, дифениловый спирт С6Н5ОС6Н5, тиофенол С6Н5 SН и резоцин С6Н4(ОН)2.
Плав поступает на гашение, которое проводиться при 40-50?С. В процессе гашения часть воды и фенола испаряется, в остатке воды растворяются фенолят натрия избыток едкого натра; образовавшийся сульфит натрия выпадает в осадок.
Пары воды и фенола, выделяющиеся при плавлении и гашении, конденсируются, и конденсат поступает на обесфеноливание.
Раствор фенолята декантируют для отделения от сульфита натрия. После декантации сульфит фильтруют и промывают на автоматической центрифуге, причем промывную воду возвращают в гаситель; часть сульфита направляют в нейтрализатор, а остальное количество выделяют и используют как товарный продукт.
После дополнительной декантации раствор фенолята поступает на разложение сернистым газом. При этом образуются сырой фенол, направляемый на ректификацию, и раствор сульфита, возвращаемый на нейтрализацию.
Недостаток сернистого газа в процессе восполняется разложением серной кислотой сульфита натрия, полученного при щелочном плавлении.
Сырой фенол подвергают перегонке в вакууме, при которой выделяются следующие фракции: фенольная вода, содержащая 6-8% фенола; фенол-сырец, содержащий до 97% фенола; товарный фенол, содержащий более 99,5% чистого фенола; первичная смола.
Оставшуюся в кубе первичную смолу также перегоняют в вакууме, отбирая две фракции – фенольную воду и фенол- сырец. В кубовом остатке (вторичной смоле) содержится 15-20% фенола, 20-25% минеральных солей и 25-30% оксидифенилов, которые могут быть выделены.
Производство фенола омылением хлорбензола.
Синтез фенола омылением хлорбензола раствором едкого натра под давлением был осуществлен в промышленном масштабе в 1927 г. фирмой «Dow Chemical Co.»- самого крупного производителя фенола этим методом – оформлен следующим образом.
Осушенный бензол обрабатывают газообразным хлором при 80?С и избыточном давлении 1,12 ат в присутствии катализатора (хлористого железа). В реакционной массе содержится 30-50% монохлорбензола, 3-12% дихлорбензола и около 30-50% непрореагировавшего бензола. Для удаления катализатора и большей части выделяющегося хлористого водорода продукт реакции промывают раствором разбавленной соляной кислоты, а затем нейтрализуют. Хлористый водород используется в дальнейшем непосредственно или в виде водного раствора.
Нейтрализованные жидкие продукты реакции подвергают ректификации. В первой (по ходу процесса) колонне отгоняют не вступивший в реакцию бензол и хлорпроизводные, из которых в следующих колоннах выделяются бензол, монохлорбензол, а также о - и п- дихлорбензолы. Непрореагировавший бензол возвращают в производственный цикл на хлорирование.
Омыление хлорбензола проводят 10-20%-ным раствором едкого натра в системе трубчатых реакторов при ~375?С и под избыточным давлением 280 ат. В качестве побочных продуктов при гидролизе хлорбензола образуются дифениловый эфир и незначительные количества о- и п-оксидифенилов:
С6Н5Сl+ С6Н5ОNa=(С6Н5)2О+Na Сl
С6Н5Сl+ С6Н5ОNa+NaОН=С6Н5С6Н4О Na + Na Сl+Н2О
Для снижения выхода дифенильного эфира к исходной смеси добавляют около 10% (С6Н5)2О. При увеличении концентрации дифенильного эфира возрастает скорость
(С6Н5)2О+ Н2О NaOH=2С6Н5ОН
что компенсирует образование (С6Н5)2О в ходе процесса.
Молекулярное соотношение реагентов: NaOH: С6Н5Сl: (С6Н5)2О-2-2,5:0,5:0,5.
После охлаждения реакционной смеси продукты реакции направляют в разделительный сосуд. Дифениловый эфир (верхний слой) собирают в специальную емкость, а фенолят натрия (нижний слой) подают в нейтрализатор и обрабатывают соляной кислотой.
В результате нейтрализации и отстаивания образуются: слой, содержащий раствор хлористого натрия, и вводно-фенольный слой. Из рассола азеотропную смесь фенол- вода отгоняют в первой ректификационной колонне и направляют в нейтрализатор; раствор Na Сl после очистки поступает на электролиз.
Вводно-фенольный слой, содержащий~75% фенола и ~25% воды, подвергают азеотропной перегонке (осушке) во второй ректификационной колонне. Далее сырой фенол поступает в вакуум-ректификационную колонну, из которой отбирают товарный фенол. Кубовый остаток, содержащий 15% фенола, ~85% о- и п-оксидифенилов и следы алкилфенолов, разделяют на компоненты при перегонке.
Производство фенола по методу Рашига.
Синтез фенола контактным гидролизом хлорбензола водяным паром (метод Рашига) в промышленном масштабе был осуществлен в Германии в 1938 г., а затем освоен СССР и США.
Процесс протекает по следующей схеме:
С6Н6+Н Сl+1/2О2=С6Н5 Сl+Н2О
С6Н5 Сl+Н2О=С6Н5ОН+Н Сl
С6Н6+1/2О2=С6Н5ОН
Первую стадию- окислительное хлорирование бензола хлористым водородом – проводят при 250-270 ?С в присутствии катализатора (окиси алюминия, активированной хлорной медью). При хлорировании, кроме хлорбензола, образуются также дихлорбензолы, причем соотношение С6Н5Сl:С6Н4Сl2 возрастает с увеличением степени конверсии. Поэтому процесс ведут при степени конверсии ~10%.
В конвертор, состоящий из заполненных катализатором ячеек, между которыми циркулирует охлажденный воздух, поступают пары бензола и соляной кислоты, а также воздух. Во избежании окисления бензола кислород берется в количестве, меньшем стехиометрического. В качестве побочных продуктов образуются полихлорбензолы и при окислении незначительных количеств бензола –двуокись и окись углерода.
Смесь, содержащую бензол, хлорбензол, полихлорбензолы, окислы углерода и Непрореагировавший хлористый водород, направляют на «парциальную» конденсацию. Несконденсировавшиеся пары поступают в хвостовой конденсатор.
Органический слой конденсата, образующийся в «парциальном» конденсаторе, нейтрализуют 10%-ным раствором едкого натра, промывают водой и подвергают ректификации, при которой вначале отгоняется Непрореагировавший бензол, возвращаемый в производственный цикл, а затем от полихлорбензолов - хлорбензол.
Кислый водный слой конденсата используют во второй стадии процесса для поглощения хлористого водорода. Конденсат из хвостого конденсатора присоединяют к возвратному хлорбензолу, а несконденсировавшиеся газы направляют на абсорбцию бензола.
Вторая стадия- контактный гидролиз хлорбензола протекает путем взаимодействия его паров с водяным паром при 400-500 ?С в присутствии катализатора (фосфата кальция). Реакция эндотермична, процесс проводят при степени конверсии, общий выход фенола уменьшается, а катализатор быстро обуглероживается, теряет активность и требует частой регенерации.
Реакция протекает при циркуляции непрореагировавшего хлорбензола и воды. Из циркулирующей смеси абсорбируется хлористый водород, выводимый в виде 15-17%-ного раствора соляной кислоты, в котором содержится 5% от общего количества образовавшегося фенола.
Основную часть фенола извлекают из циркулирующей смеси промывкой горячей водой и последующей экстракцией бензолом.
Фенол, содержащийся в растворе разбавленной соляной кислоты, также извлекают бензолом. Раствор хлористого водорода возвращают на окислительное хлорирование. Таким образом, хлористый водород постоянно циркулирует в системе, и на практике приходится компенсировать лишь некоторые его потери.
Из бензольного раствора фенола отгоняют бензол и выделенный фенол- сырец подвергают вакуум - ректификации для получения товарного фенола.
Производство фенола совместно с ацетоном через гидроперекись изопропилбензола.
В 1949 г. в СССР впервые в мире был осуществлен в промышленном масштабе процесс совместного получения фенола и ацетона через гидроперекись изопропилбензола (кумола).
Кумольный метод получения фенола разработан на основе исследований П.Г.Сергеева, Р.Ю. Удриса, Б.Д. Кружалова и М.С.Немцова.
В 1953 г. в результате работ английской фирмы «Distillers Companu Limited» и американской фирмы «Hercules Powder Companu» аналогичный процесс был внедрен на заводе фирмы «British- AmericanShowingan» в г. Монреале (Канада). С этого времени Кумольный метод синтеза фенола получил широкое распространение во многих странах.
Процесс состоит из следующих стадий:
1. Получение изопропилбензола (кумола) алкилированием бензола пропиленом:
С6Н6-СН2=СН-СН3=С6Н6-СН (СН3)2
2. Окисление изопропилбензола кислородом воздуха в гидроперекись:
С6Н5-СН(СН3)2+О2=С6Н5-С(СН3)2-О-ОН
3. Разложение гидроперекиси изопропилбензола на фенол и ацетон:
С6Н5-С(СН3)2-О-ОН=С6Н5ОН+(СН3)2СО
Оценка Эффективности кумольного метода и путей его развития может быть произведена только при сравнении с другими методами.
Сравнение методов.
Метод совместного производства фенола и ацетона через гидроперекись изопропилбензола имеет ряд очевидных преимуществ перед другими методами синтеза фенола.
При получении фенола через бензолсульфокислоту необходимо расходовать большие количества таких веществ, как серная кислота, едкий натр, сернистый газ; аппаратура подвергается интенсивной коррозии, целый ряд процессов оформляется периодически, условия проведения отдельных стадий процесса весьма жестки.
Синтез фенола омылением хлорбензола связан с расходом значительных количеств хлора, щелочи, соляной кислоты. Использование в процессе сильно агрессивных веществ требует применения дорогих антикоррозийных материалов. Недостатком является также работа под высоким избыточным давлением (до 300ат).
Метод Рашига характеризуется использованием в процессе больших количеств хлористого водорода, коррозией, жесткими условиями проведения реакции и низкой конверсией за один проход, что обуславливает высокие энергозатраты.
Кумольный метод фенола выгодно отличается от перечисленных методов мягкими условиями проведения всех стадий процесса, применением значительно меньших количеств серной кислоты и щелочи, отсутствием хлора и соляной кислоты. Коррозия аппаратуры, возникающая при алкилировании вследствие гидролиза катализатора (хлористого алюминия) и при окислении в результате побочно образующейся муравьиной кислоты, менее интенсивна и предотвращается легче, чем коррозия
(373.01 Кб) скачиваний1121 раз(а)
Основная цель этого процесса состоит в производстве металлургического кокса. Побочно образуются жидкие продукты коксования и газ. Перегонкой жидких продуктов коксования наряду с бензолом, толуолом и нафталином получают фенол, тиофен, пиридин и их гомологи, а также более сложные аналоги с конденсированными ядрами. Доля каменноугольного фенола,по сравнению с получаемым кумольным методом, незначительна.
2. Замещение галогена в ароматических соединениях
Замещение галогена на гидроксильную группу протекает в жестких условиях и известно как «Дау»-процесс (1928 г.)
Раньше этим способом получали фенол (из хлорбензола), но теперь его значение снизилось в связи с разработкой более экономичных способов, не связанных с затратами хлора и щелочи и образованием большого количества сточных вод.
В активированных галогенаренах (содержащих наряду с галогеном нитрогруппу в о- и п- положениях) замещение галогена протекает в более мягких условиях:

Это можно объяснить электроноакцепторным влиянием нитрогруппы, которая оттягивает на себя электронную плотность бензольного кольца и таким образом участвует в стабилизации σ-комплекса:

3. Способ Рашига
Это видоизмененный хлорный метод: бензол подвергается окислительному хлорированию действием хлористого водорода и воздуха, и затем, не выделяя образовавшийся хлорбензол, гидролизуют его водяным паром в присутствии солей меди. В результате хлор вообще не расходуется, а суммарный процесс сводится к окислению бензола в фенол:
4.Сульфонатный способ
Фенолы можно получить с хорошим выходом при сплавлении ароматических сульфокислот Ar-SO 3 H со смесью гидроксидов натрия и калия (реакция щелочного плавления ) при 300С с последующей нейтрализацией образующегося алкоголята путем добавления кислоты:

Метод эксплуатируется в промышленности до сих пор (для получения фенола) и используется в лабораторной практике.
5. Кумольный метод
Первое крупное производство фенола кумольным методом было осуществлено в 1949 г. в Советском Союзе. В настоящее время это основной метод получения фенола и ацетона.
Метод включает две стадии: окисление изопропилбензола (кумола) кислородом воздуха до гидропероксида и его кислотное разложение:

Преимуществом данного метода является отсутствие побочных продуктов и высокая потребность конечных продуктов – фенола и ацетона. Метод был разработан в нашей стране Р.Ю. Удрисом, Б.Д. Круталовым и др. в 1949 г.
6. Из солей диазония
Метод заключается в нагревании солей диазония в разбавленной серной кислоте, что приводит к гидролизу – замене диазогруппы на гидроксигруппу. Синтез весьма удобен для получения гидроксиаренов в лабораторных условиях:

Строение фенолов
Строение и распределение электронной плотности в молекуле фенола можно изобразить следующей схемой:

Дипольный момент фенола составляет 1.55 Д и направлен в сторону бензольного кольца. Гидроксильная группа по отношению к бензольному кольцу проявляет –I эффект и +М эффект. Так как мезомерный эффект гидроксигруппы преобладает над индукционным, сопряжение неподеленных электронных пар атома кислорода с -орбиталями бензольного кольца оказывает электронодонорное влияние на ароматическую систему, что повышает ее реакционную способность в реакциях электрофильного замещения.