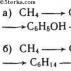а) Из метана при нагревании можно получит ацетилен:
В присутствии катализатора ацетилен превращается в бензол (реакция тримеризации):

Фенол из бензола можно получить в две стадии. Бензол реагирует с хлором в присутствии хлорида железа, при этом образуется хлорбензол:

При действии на хлорбензол щелочи при высокой температуре происхо дит замещение атома хлора на гидроксильную группу и получается фенол:

При действии на фенол брома образуется 2,4,6-трибромфенол:

б) Этан из метана можно получить в две стации. При хлорировании метана образуется хлорметан. При хлорировании метана на свету образуется хлорметан:
При взаимодействии хлорметана с натрием образуется этан (реакция Вюрца):
Пропан из этана также можно получить в две стадии. При хлорировании этана образуется хлорэтан:
При реакции хлорэтана с хлорметаном в присутствии натрия образуется пропан:
Из пропана в две стадии можно получить гексан. При хлорировании пропана образуется смесь изомеров - 1-хлорпропана и 2-хлорпропана. Изомеры имеют разные температуры кипения и их можно разделить перегонкой.
При взаимодействии 1-хлорпропана с натрием образуется гексан:
При дегидрировании гексана над катализатором образуется бензол:

Из бензола можно в три стадии получить пикриновую кислоту (2,4,6-тринитрофенол). При реакции бензола с хлором в присутствии хлорида железа образуется хлорбензол.
Способы получения />.
1 . Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
С 6 Н 5 ― С l + 2 NaOH → C 6 H 5 ― ONa + NaCl + Н 2 О.
2. При каталитическом окислении изопропилбензола (кумола) кислородом воздуха образуются фенол и ацетон:
(1)
Это - основной промышленный способ получения фенола.
3. Получение из ароматических сульфокислот. Реакция проводится при сплавлении сульфокислот с щелочами. Первоначально образующиеся феноксиды обрабатывают сильными кислотами для получения свободных фенолов. Метод обычно применяют для получения многоатомных фенолов:

Химические свойства />. В фенолах p -орбиталь атома кислорода образует с ароматическим кольцом единую p -систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О-Н увеличивается, и водород ОН-группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов).
1. Кислотность фенола существенно выше, чем у предельных спиртов; он реагирует как с щелочными металлами:
С 6 Н 5 ОН + Na → C 6 H 5 ONa + 1/2 H 2 ,
так и с их гидроксидами (отсюда старинное название "карболовая кислота"):
С 6 Н 5 ОН + NaOH → C 6 H 5 ONa + Н 2 О.
Фенол, однако, является очень слабой кислотой. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол; такая реакция доказывает, что фенол - более слабая кислота, чем угольная и сернистая:
C 6 H 5 ONa + СО 2 + Н 2 О → С 6 Н 5 ОН + NaHCO 3 .
Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода.
2. Образование сложных эфиров. В отличие от спиртов, фенолы не образуют сложных эфиров при действии на них карбоновых кислот; для этого используются хлорангидриды кислот:
С 6 Н 5 ОН + СН 3 ― CO ― Cl → С 6 Н 5 ― О― СО― СН 3 + HCl .
3. Реакции электрофильного замещения в феноле протекают значительно легче, чем в ароматических углеводородах. Поскольку ОН группа является ориентантом I рода, то в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара-положениях (при галогенировании, нитровании, поликонденсации и т.д.). Так, при действии бромной воды на фенол три атома водорода замещаются на бром, и образуется осадок 2,4,6-трибромфенола:
 (2)
(2)
Это - качественная реакция на фенол.
При нитровании фенола концентрированной азотной кислотой три атома водорода замещаются на нитрогруппу, и образуется 2,4,6-тринитрофенол (пикриновая кислота):

При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации, и образуется фенолформальдегидная смола - высокомолекулярное соединение с разветвленной структурой типа:

4. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
 (3)
(3)
В заключение отметим, что для идентификации фенола очень часто используется его реакция с раствором FeCl 3 ; при этом образуется комплексный ион фиолетового цвета. Наряду с реакцией (2), это - качественная реакция на обнаружение фенола.
Применение . Фенол используют как полупродукт при получении фенолформальдегидных смол, синтетических волокон, красителей, лекарственных средств и многих других ценных веществ. Пикриновую кислоту применяют в промышленности в качестве взрывчатого вещества. Крезолы используют как вещества с сильным дезинфицирующим действием./>
Фенолы — органические вещества,молекулы которых содержат радикал фенил,связанный с одной или несколькими гидроксогруппами. Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:

Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:

Существуют и многоатомные фенолы, содержащие три и более гидроксильных групп в бензольном кольце.
Познакомимся поподробнее со строением и свойствами простейшего представителя этого класса- фенолом С 6 Н 5 ОН. Название этого вещества и легло в основу в основу названия всего касса — фенолы.
Физические свойства фенола
Фенол-твердое, бесцветное кристаллическое вещества, t°плавления=43°С, t°кипения=181°С, с резким характерным запахом.Ядовит.Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой.При попадании на кожу он вызывает ожоги,поэтому с фенолом нужно обращаться очень осторожно!
Химические свойства фенола
 Фенолы в большинстве реакций по связи О–Н активнее , поскольку эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие неподеленной электронной пары атома кислорода в системе p-сопряжения). Кислотность фенолов значительно выше, чем спиртов. Для фенолов реакции разрыва связи С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях ( ОН-группы)
Фенолы в большинстве реакций по связи О–Н активнее , поскольку эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие неподеленной электронной пары атома кислорода в системе p-сопряжения). Кислотность фенолов значительно выше, чем спиртов. Для фенолов реакции разрыва связи С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях ( ОН-группы)
Кислотные свойства фенола
Атом водорода гидроксильной группы обладает кислотным характером. Т.к. кислотные свойства у фенола выражены сильнее, чем у воды и спиртов, то фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:

Кислотность фенолов зависит от природы заместителей (донор или акцептор электронной плотности), положения относительно ОН-группы и от количества заместителей. Наибольшее влияние на ОН-кислотность фенолов оказывают группы, расположенные в орто- и пара-положениях. Доноры увеличивают прочность связи О-Н (тем самым уменьшая подвижность водорода и кислотные свойства), акцепторы уменьшают прочность связи О-Н, при этом кислотность возрастает:

Однако кислотные свойства у фенола выражены слабее, чем у неорганический и карбоновых кислот. Так, например, кислотные свойства фенола примерно в 3000 раз меньше,чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол.

Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:

Качественная реакция на фенол
Фенол реагирует с хлоридом железа (3) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах.Другие фенолы,содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа(3).
Реакции бензольного кольца фенола
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
- Бромирование фенола. В отличие от бензола для бромирования фенола не требуется добавление катализатора (бромид железа(3)). Кроме того, взаимодействие с фенолом протекает селективно (избирательно): атомы брома направляются в орто- и пара- положения, замещая находящиеся там атомы водорода. Селективность замещения объясняется рассмотренными выше особенностями электронного строения молекулы фенола.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:

Эта реакция, так же как и реакция с хлоридом железа(3), служит для качественного обнаружения фенола .
2. Нитрирование фенола также происходит легче, чем нитрирование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и паро изомеров нитрофенола:

При использовании концентрированной азотной кислоты образуется 2,4,6, тринитритфенол-пикриновая кислота, взрывчатое вещество:

3. Гидрирование ароматического ядра фенола в присутствии катализатора проходит легко:

4. Поликонденсация фенола с альдегидами, в частности, с формальдегидом происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:

В молекуле димера сохраняются «подвижные» атомы водорода, а значит,возможно дальнейшее продолжение реакции при достаточном количестве реагентов:

Реакция поликонденсаци, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта(воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:

Образование линейных молекул происходит при обычной температуре. Проведение этой же реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде.В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимера на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению,действию воды, щелочей, кислот.Они обладают высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин,полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы,сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе.Таким образом, фенол и продукты на его основе находят широкое применение.
Применение фенолов
Фенол — твердое вещество, с характерным запахом, вызывает ожоги при попадании на кожу. Ядовит. Растворяется в воде, его раствор называют карболовой кислотой (антисептик). Она была первым антисептиком введенным в хирургию. Широко используется для производства пластмасс, лекарственных средств (салициловая кислота и ее производные), красителей, взрывчатых веществ.
Производство фенола сульфированием бензола.
Расчеты по производству фенола 1000р
Синтетический фенол в промышленном масштабе был получен впервые в 1899 г. на Баденской анилино - содовой фабрике сульфированием бензола. С тех пор этот метод, в значительной степени, видоизмененной и улучшенный, широко применяется во многих странах мира.
Сульфирование бензола
С6Н6+Н2SО4=С6Н5SО3Н+Н2О
Нейтрализация сульфокислоты
2С6Н5SО3Н+Na2SО3 =2С6Н5SО3 Na+Н2О+SО2
Щелочное плавление
С6Н5 SО3 Na+2 NaОН=С6Н5 О Na+ Na2SО3+Н2О
Разложение фенолята натрия
2 С6Н5 О Na+ SО2+Н2О=2С6Н5 ОН+ Na2SО3
Сульфирование бензола можно проводить в жидкой фазе, в паровой фазе и двухступенчатым методом.
Метод сульфирования бензола в паровой фазе был разработан Р.К. Эйхманом и является наиболее экономичным. Себестоимость фенола, полученного по этому методу, на 10% ниже себестоимости фенола, производимого по применяемому в ФРГ методу сульфирования бензола в жидкой фазе, и на 6% ниже себестоимости фенола, вырабатываемого по методу, распространенному в США (двухступенчатый метод).
Парофазный процесс сульфирования бензола проводиться непрерывным способом. Пары бензола поступают параллельно через барботеры в четыре каскадно-расположенных сульфуратора, снабженных мешалками и рубашками. На сульфирование подается 94-95%-ная серная кислота, которая вводится через барботеры в первый из сульфураторов. Образующаяся сульфомасса последовательно перетекает из донного сульфуратора в другой. При сульфировании протекают следующие побочные реакции:
а) образование дифенилсульфона:
С6Н5SО3Н+С6Н6?С6Н5SО2С6Н5+Н2О
б) Образование дисульфокислоты бензола:
С6Н5SО3Н+Н2SО4?С6Н4(SО3Н)2+ Н2О
в) полное окисление бензола:
С6Н6+15 SО3?6СО2+3 Н2О+15 SО2
Эти нежелательные реакции ускоряются при повышении температуры, вследствие чего в сульфураторах поддерживается температура не выше 160?С. Пары воды и бензола, выделяющиеся при сульфировании, конденсируются, а отслоившийся бензол после нейтрализации возвращается на сульфирование.
Полученная сульфомасса поступает на отдувку бензола, поскольку при температуре сульфирования растворяется около 1,5% бензола от веса сульфомассы. В результате отдувки, проводимой в вакууме или с помощью инертного газа, содержание бензола в ней снижается до 0,1-0,2%.
Пары бензола, выделившиеся при отдувке, частично конденсируются, остаток бензола адсорбируется из газов. Бензол, полученный при конденсации и регенерации адсорбента, присоединяется к возвратному бензолу.
Сульфомасса после отгонки бензола подвергается непрерывной нейтрализации суспензий сульфита натрия. Образующийся при этом сернистый газ используется в дальнейшем для разложения фенолята натрия.
Насыщенный раствор сульфосоли поступает на щелочное плавление, которое проводиться периодически в котле, обогреваемом топочными газами. Для плавления применяют 80-85%-ный раствор NaОН; процесс ведут при 285-315?С.
На этой стадии протекают побочные реакции, в результате которых образуются о- ип-оксидифенилы С6Н5С6Н4ОН, дифениловый спирт С6Н5ОС6Н5, тиофенол С6Н5 SН и резоцин С6Н4(ОН)2.
Плав поступает на гашение, которое проводиться при 40-50?С. В процессе гашения часть воды и фенола испаряется, в остатке воды растворяются фенолят натрия избыток едкого натра; образовавшийся сульфит натрия выпадает в осадок.
Пары воды и фенола, выделяющиеся при плавлении и гашении, конденсируются, и конденсат поступает на обесфеноливание.
Раствор фенолята декантируют для отделения от сульфита натрия. После декантации сульфит фильтруют и промывают на автоматической центрифуге, причем промывную воду возвращают в гаситель; часть сульфита направляют в нейтрализатор, а остальное количество выделяют и используют как товарный продукт.
После дополнительной декантации раствор фенолята поступает на разложение сернистым газом. При этом образуются сырой фенол, направляемый на ректификацию, и раствор сульфита, возвращаемый на нейтрализацию.
Недостаток сернистого газа в процессе восполняется разложением серной кислотой сульфита натрия, полученного при щелочном плавлении.
Сырой фенол подвергают перегонке в вакууме, при которой выделяются следующие фракции: фенольная вода, содержащая 6-8% фенола; фенол-сырец, содержащий до 97% фенола; товарный фенол, содержащий более 99,5% чистого фенола; первичная смола.
Оставшуюся в кубе первичную смолу также перегоняют в вакууме, отбирая две фракции – фенольную воду и фенол- сырец. В кубовом остатке (вторичной смоле) содержится 15-20% фенола, 20-25% минеральных солей и 25-30% оксидифенилов, которые могут быть выделены.
Производство фенола омылением хлорбензола.
Синтез фенола омылением хлорбензола раствором едкого натра под давлением был осуществлен в промышленном масштабе в 1927 г. фирмой «Dow Chemical Co.»- самого крупного производителя фенола этим методом – оформлен следующим образом.
Осушенный бензол обрабатывают газообразным хлором при 80?С и избыточном давлении 1,12 ат в присутствии катализатора (хлористого железа). В реакционной массе содержится 30-50% монохлорбензола, 3-12% дихлорбензола и около 30-50% непрореагировавшего бензола. Для удаления катализатора и большей части выделяющегося хлористого водорода продукт реакции промывают раствором разбавленной соляной кислоты, а затем нейтрализуют. Хлористый водород используется в дальнейшем непосредственно или в виде водного раствора.
Нейтрализованные жидкие продукты реакции подвергают ректификации. В первой (по ходу процесса) колонне отгоняют не вступивший в реакцию бензол и хлорпроизводные, из которых в следующих колоннах выделяются бензол, монохлорбензол, а также о - и п- дихлорбензолы. Непрореагировавший бензол возвращают в производственный цикл на хлорирование.
Омыление хлорбензола проводят 10-20%-ным раствором едкого натра в системе трубчатых реакторов при ~375?С и под избыточным давлением 280 ат. В качестве побочных продуктов при гидролизе хлорбензола образуются дифениловый эфир и незначительные количества о- и п-оксидифенилов:
С6Н5Сl+ С6Н5ОNa=(С6Н5)2О+Na Сl
С6Н5Сl+ С6Н5ОNa+NaОН=С6Н5С6Н4О Na + Na Сl+Н2О
Для снижения выхода дифенильного эфира к исходной смеси добавляют около 10% (С6Н5)2О. При увеличении концентрации дифенильного эфира возрастает скорость
(С6Н5)2О+ Н2О NaOH=2С6Н5ОН
что компенсирует образование (С6Н5)2О в ходе процесса.
Молекулярное соотношение реагентов: NaOH: С6Н5Сl: (С6Н5)2О-2-2,5:0,5:0,5.
После охлаждения реакционной смеси продукты реакции направляют в разделительный сосуд. Дифениловый эфир (верхний слой) собирают в специальную емкость, а фенолят натрия (нижний слой) подают в нейтрализатор и обрабатывают соляной кислотой.
В результате нейтрализации и отстаивания образуются: слой, содержащий раствор хлористого натрия, и вводно-фенольный слой. Из рассола азеотропную смесь фенол- вода отгоняют в первой ректификационной колонне и направляют в нейтрализатор; раствор Na Сl после очистки поступает на электролиз.
Вводно-фенольный слой, содержащий~75% фенола и ~25% воды, подвергают азеотропной перегонке (осушке) во второй ректификационной колонне. Далее сырой фенол поступает в вакуум-ректификационную колонну, из которой отбирают товарный фенол. Кубовый остаток, содержащий 15% фенола, ~85% о- и п-оксидифенилов и следы алкилфенолов, разделяют на компоненты при перегонке.
Производство фенола по методу Рашига.
Синтез фенола контактным гидролизом хлорбензола водяным паром (метод Рашига) в промышленном масштабе был осуществлен в Германии в 1938 г., а затем освоен СССР и США.
Процесс протекает по следующей схеме:
С6Н6+Н Сl+1/2О2=С6Н5 Сl+Н2О
С6Н5 Сl+Н2О=С6Н5ОН+Н Сl
С6Н6+1/2О2=С6Н5ОН
Первую стадию- окислительное хлорирование бензола хлористым водородом – проводят при 250-270 ?С в присутствии катализатора (окиси алюминия, активированной хлорной медью). При хлорировании, кроме хлорбензола, образуются также дихлорбензолы, причем соотношение С6Н5Сl:С6Н4Сl2 возрастает с увеличением степени конверсии. Поэтому процесс ведут при степени конверсии ~10%.
В конвертор, состоящий из заполненных катализатором ячеек, между которыми циркулирует охлажденный воздух, поступают пары бензола и соляной кислоты, а также воздух. Во избежании окисления бензола кислород берется в количестве, меньшем стехиометрического. В качестве побочных продуктов образуются полихлорбензолы и при окислении незначительных количеств бензола –двуокись и окись углерода.
Смесь, содержащую бензол, хлорбензол, полихлорбензолы, окислы углерода и Непрореагировавший хлористый водород, направляют на «парциальную» конденсацию. Несконденсировавшиеся пары поступают в хвостовой конденсатор.
Органический слой конденсата, образующийся в «парциальном» конденсаторе, нейтрализуют 10%-ным раствором едкого натра, промывают водой и подвергают ректификации, при которой вначале отгоняется Непрореагировавший бензол, возвращаемый в производственный цикл, а затем от полихлорбензолов - хлорбензол.
Кислый водный слой конденсата используют во второй стадии процесса для поглощения хлористого водорода. Конденсат из хвостого конденсатора присоединяют к возвратному хлорбензолу, а несконденсировавшиеся газы направляют на абсорбцию бензола.
Вторая стадия- контактный гидролиз хлорбензола протекает путем взаимодействия его паров с водяным паром при 400-500 ?С в присутствии катализатора (фосфата кальция). Реакция эндотермична, процесс проводят при степени конверсии, общий выход фенола уменьшается, а катализатор быстро обуглероживается, теряет активность и требует частой регенерации.
Реакция протекает при циркуляции непрореагировавшего хлорбензола и воды. Из циркулирующей смеси абсорбируется хлористый водород, выводимый в виде 15-17%-ного раствора соляной кислоты, в котором содержится 5% от общего количества образовавшегося фенола.
Основную часть фенола извлекают из циркулирующей смеси промывкой горячей водой и последующей экстракцией бензолом.
Фенол, содержащийся в растворе разбавленной соляной кислоты, также извлекают бензолом. Раствор хлористого водорода возвращают на окислительное хлорирование. Таким образом, хлористый водород постоянно циркулирует в системе, и на практике приходится компенсировать лишь некоторые его потери.
Из бензольного раствора фенола отгоняют бензол и выделенный фенол- сырец подвергают вакуум - ректификации для получения товарного фенола.
Производство фенола совместно с ацетоном через гидроперекись изопропилбензола.
В 1949 г. в СССР впервые в мире был осуществлен в промышленном масштабе процесс совместного получения фенола и ацетона через гидроперекись изопропилбензола (кумола).
Кумольный метод получения фенола разработан на основе исследований П.Г.Сергеева, Р.Ю. Удриса, Б.Д. Кружалова и М.С.Немцова.
В 1953 г. в результате работ английской фирмы «Distillers Companu Limited» и американской фирмы «Hercules Powder Companu» аналогичный процесс был внедрен на заводе фирмы «British- AmericanShowingan» в г. Монреале (Канада). С этого времени Кумольный метод синтеза фенола получил широкое распространение во многих странах.
Процесс состоит из следующих стадий:
1. Получение изопропилбензола (кумола) алкилированием бензола пропиленом:
С6Н6-СН2=СН-СН3=С6Н6-СН (СН3)2
2. Окисление изопропилбензола кислородом воздуха в гидроперекись:
С6Н5-СН(СН3)2+О2=С6Н5-С(СН3)2-О-ОН
3. Разложение гидроперекиси изопропилбензола на фенол и ацетон:
С6Н5-С(СН3)2-О-ОН=С6Н5ОН+(СН3)2СО
Оценка Эффективности кумольного метода и путей его развития может быть произведена только при сравнении с другими методами.
Сравнение методов.
Метод совместного производства фенола и ацетона через гидроперекись изопропилбензола имеет ряд очевидных преимуществ перед другими методами синтеза фенола.
При получении фенола через бензолсульфокислоту необходимо расходовать большие количества таких веществ, как серная кислота, едкий натр, сернистый газ; аппаратура подвергается интенсивной коррозии, целый ряд процессов оформляется периодически, условия проведения отдельных стадий процесса весьма жестки.
Синтез фенола омылением хлорбензола связан с расходом значительных количеств хлора, щелочи, соляной кислоты. Использование в процессе сильно агрессивных веществ требует применения дорогих антикоррозийных материалов. Недостатком является также работа под высоким избыточным давлением (до 300ат).
Метод Рашига характеризуется использованием в процессе больших количеств хлористого водорода, коррозией, жесткими условиями проведения реакции и низкой конверсией за один проход, что обуславливает высокие энергозатраты.
Кумольный метод фенола выгодно отличается от перечисленных методов мягкими условиями проведения всех стадий процесса, применением значительно меньших количеств серной кислоты и щелочи, отсутствием хлора и соляной кислоты. Коррозия аппаратуры, возникающая при алкилировании вследствие гидролиза катализатора (хлористого алюминия) и при окислении в результате побочно образующейся муравьиной кислоты, менее интенсивна и предотвращается легче, чем коррозия
(373.01 Кб) скачиваний1121 раз(а)
Описание презентации по отдельным слайдам:
1 слайд
Описание слайда:
2 слайд
Описание слайда:
Цель: Дать характеристику физических и химических свойств фенола Показать отрицательную и положительную роль в природе и жизни человека фенола и его производных
3 слайд
Описание слайда:
Фенол (оксибензол, устар. карболовая кислота) C6H5OH - простейший представитель класса фенолов. Кристаллическое, бесцветное вещество с характерным запахом. На воздухе легко окисляется, приобретая вначале розовую, затем бурую окраску. Игольчатые кристаллы фенола
4 слайд
Описание слайда:
Классификация фенолов Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле:
5 слайд
Описание слайда:
Получение Кумольный способ получения фенола (СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. Сплавлением солей ароматических сульфокислот с твёрдыми щелочами: C6H5-SO3Na + NaOH t → Na2SO3 + С6H5 – OH Из каменноугольной смолы: C6H5ONa + H2SO4(разб) → С6H5 – OH + NaHSO4 Из галогенбензолов: С6H5-Cl + NaOH t,p → С6H5 – OH + NaCl
6 слайд
Описание слайда:
Физические свойства Растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. Фенол крайне ядовит и опасен для человеческого организма
7 слайд
Описание слайда:
Электронное строение Гидроксильная группа -OH является заместителем I рода, то есть она способствует повышению электронной плотности в бензольном кольце (особенно в орто- и пара-положениях). Это обусловлено тем, что одна из неподелённых пар электронов атома кислорода OH-группы вступает в сопряжение с π-системой бензольного кольца. Смещение неподелённой пары электронов атома кислорода в сторону бензольного кольца приводит к увеличению полярности связи O-H.
8 слайд
Описание слайда:
Химические свойства Взаимодействие с металлическим натрием: 2C6H5OH + 2Na 2C6H5ONa + H2 Обладает слабыми кислотными свойствами, при действии щелочей образует соли - феноляты (например, фенолят натрия - C6H5ONa): C6H5OH + NaOH C6H5ONa + H2O Взаимодействие с бромной водой (качественная реакция на фенол): C6H5OH + 3Br2 C6H2Br3OH + 3HBr (образуется твёрдое вещество белого цвета 2,4,6-трибромфенол) Взаимодействие с концентрированной азотной кислотой: C6H5OH + 3HNO3 C6H2(NO2)3OH + 3H2O (образуется 2,4,6-тринитрофенол) Взаимодействие с хлоридом железа(III) (качественная реакция на фенол): 6C6H5OH + FeCl3 Cl3
9 слайд
Описание слайда:
Биологическая роль Эфирные масла (обладают сильными бактерицидными и противовирусными свойствами, стимулируют иммунную систему, повышают артериальное давление: - анетол в укропе, фенхеле, анисе - карвакрол и тимол в чабреце - эвгенол в гвоздике, базилике Флавоноиды (способствуют удалению радиоактивных элементов из организма) Лекарственные препараты (пурген, парацетамол) Антисептики (3-5 % раствор –карболовая кислота) Фенол - один из промышленных загрязнителей. Фенол довольно токсичен для животных и человека. Фенол губителен для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке.
10 слайд
Описание слайда:
Токсические свойства Относится к высокоопасным веществам (Класс опасности II). При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Попадая на кожу, фенол очень быстро всасывается даже через неповреждённые участки и уже через несколько минут начинает воздействовать на ткани головного мозга.
11 слайд
Описание слайда:
Токсические свойства Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами
12 слайд
Описание слайда:
Воздействие на организм При попадании фенольного раствора на кожный покров сразу же появляются сильные ожоги химического характера, переходящие в язвы. Если четверть всей поверхности тела обожжена воздействием фенола, то вероятность смерти близка к 100%. Попадание вещества в организм через желудочно-кишечный тракт способствует затруднению движения, может спровоцировать кровотечение, язву. Смертельная доза для человека при попадании внутрь 1-10 г, для детей 0,05-0,5 г. Несмотря на быстрый период выведения из организма (всего сутки), фенол способен нанести непоправимый урон, а лечение может занять несколько лет. Наиболее серьезные последствия – развитие онкологических заболеваний, бесплодие, проблемы с сердцем.